新西兰的保健食品监管
在2010年3月31日之前,新西兰将与中国保健食品类似的产品称为膳食补充剂(dietary supplements),依据《膳食补充剂条例(1985)》进行管理。自2010年3月31日起,新西兰对食品形态的膳食补充剂进行单独管理,并必须符合《新西兰食品(补充食品)标准》的要求,称为补充食品(Supplemented Food)。
1、对膳食补充剂的定义是:液体、粉剂或片剂(可在标签上标示为扁囊剂、胶囊剂、菱形糖果或含片),可能含有氨基酸、可食用物质、草药、矿物质、合成营养素或维生素,需口服食用,可单独或混合销售。但不包括以下受管制药物:(1)《滥用药物法(1975)》所列的管制药物;(2)《药品条例(1984)》附表1所列物质;(3)依据《药品法(1981)》在药房售卖或药剂师开出的处方药,以及有明示或暗示治疗目的物质。
2、对补充食品的定义是:因添加了一种或多种物质,或者经过某种方式修饰而超出简单营养需求,发挥生理作用的食品,并且不包括以下产品:(a)膳食补充剂;(b)管制药物或限制物质(《滥用药物法(1975)》);(c)代餐食品或辅食(《澳新食品标准法典》);(d)含咖啡因的饮料(《澳新食品标准法典》)。
目前,新西兰对膳食补充剂进行监管的主要机构是新西兰卫生部的药品和医疗器械安全局(Medsafe);对补充食品进行监管的主要机构是新西兰初级产业部(MPI)、澳新食品标准局(FSANZ)等。监管框架图如下:
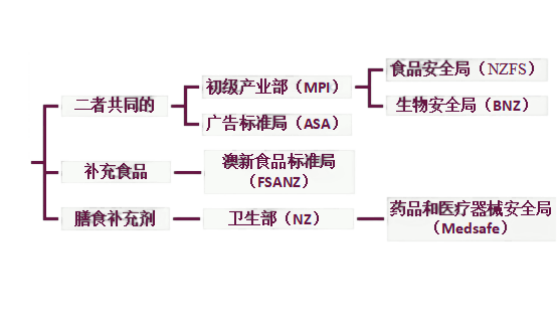
一般情况下,膳食补充剂和补充食品不需上市前审批。但补充食品和大多数膳食补充剂生产企业需注册相应风险计划,包括食品控制计划(Food Control Plans,FCP)、国家计划(National Programme,NP)或风险管理计划(Risk Management Programme,RMP)。但对于叶酸每日最大剂量大于300mcg的膳食补充剂,在上市前需要向Medsafe申请审批。生产要遵守《新西兰药品生产和销售的良好生产规范》(第4部分)的要求,并在生产前向Medsafe提交其生产符合良好生产规范的资料。具体法规要求可见下表。
| 具体要求 | 补充食品 | 膳食补充剂 |
|---|---|---|
成分要求 | 除《新西兰食品(补充食品)标准(2016)》中有明确限制或禁止的,只要安全且适合添加的任何维生素、矿物质、植物或生物活性物质都可以添加到补充食品中。 | 《膳食补充剂条例(1985)》规定,可用原料包括除了偶然成分(膳食补充剂含有的任何外来物质、有毒物质或农药,不包括防腐剂、抗氧化剂、着色剂、人造甜味剂、香料、食品调理剂、抗结块剂、气态包装剂、推进剂、维生素或矿物质)之外的任何生产膳食补充剂所需的物质。不包括受管制药物。 |
声称要求 | 可使用《法典》Standard 1.2.7中规定的声称,但禁止使用治疗性功能声称。 | 《膳食补充剂条例(1985)》规定膳食补充剂不能使用治疗性声称。 |
质量要求 | 按注册的FCP、NP或RMP进行生产。 | 含叶酸的膳食补充剂按《新西兰药品生产和销售的良好生产规范》(第4部分)进行生产;需注册FCP、NP或RMP的,按注册的风险计划生产。 |
标签要求 | 遵守《新西兰食品(补充食品)标准(2016)》和《澳新食品标准法典》标签标识相应章节的规定。 | 按《膳食补充剂条例(1985)》第5条的规定。 |
上市后监管 | 实施食品抽检制度、食品追溯和召回制度。 | 实施不良反应报告、产品召回制度。 |
相关资讯
-
无
 粤ICP备17062322号
粤ICP备17062322号 粤公网安备 44010602010620号
粤公网安备 44010602010620号